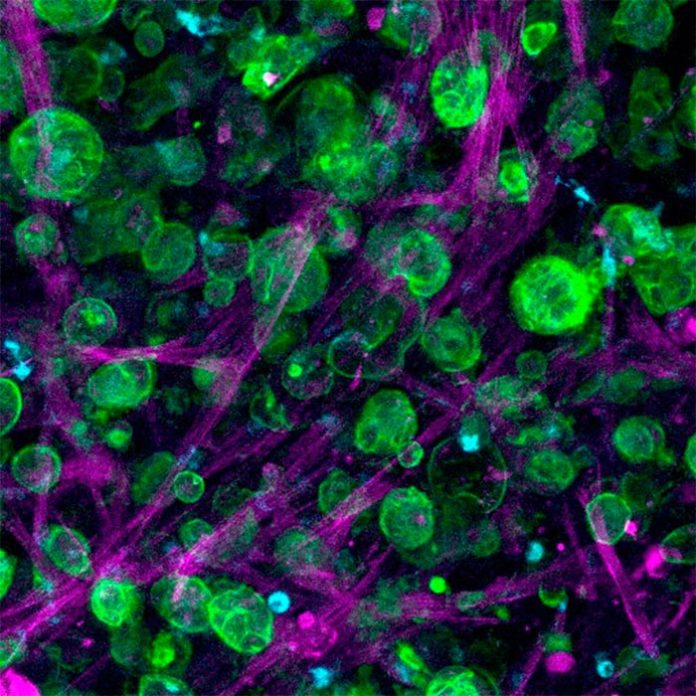

Un equipo internacional de científicos ha creado un modelo de tumor de cáncer de páncreas tridimensional (3-D) en el laboratorio, combinando una matriz de bioingeniería y células derivadas de pacientes que podrían usarse para desarrollar y probar tratamientos específicos.
En un nuevo estudio publicado hoy en Nature Communications, investigadores de la Universidad de Nottingham, la Universidad Queen Mary de Londres, la Universidad Monash y la Universidad Jiao Tong de Shanghai han creado un microambiente tridimensional multicelular, que utiliza células derivadas de pacientes para recrear la forma en que las células tumorales crecen en el cáncer de páncreas y responden a los medicamentos de quimioterapia.
Las respuestas a los fármacos fueron mejor reproducidas en nuestros cultivos autoensamblados con cáncer de páncreas que en los otros modelos
El cáncer de páncreas es muy difícil de tratar, sobre todo porque no hay signos ni síntomas hasta que el cáncer se ha diseminado. Puede ser resistente al tratamiento y la tasa de supervivencia es baja en comparación con otros cánceres, con sólo una tasa de supervivencia del 5 al 10% cinco años después del diagnóstico.
El estudio fue dirigido por los profesores Álvaro Mata de la Universidad de Nottingham (Reino Unido), Daniela Loessner de la Universidad de Monash (Australia) y Christopher Heeschen de la Universidad Jiao Tong de Shanghai (China). El Dr. David Osuna de la Peña, investigador principal del proyecto, comenta que «hay dos obstáculos principales para tratar el cáncer de páncreas: una matriz muy densa de proteínas y la presencia de células madre cancerosas (CSC) altamente resistentes que están involucradas en recaída y metástasis. En nuestro estudio, hemos diseñado una matriz en la que los CSC pueden interactuar con otros tipos de células y, juntos, comportarse más como lo hacen en el cuerpo, lo que abre la posibilidad de probar diferentes tratamientos de una manera más realista«.
Existe la necesidad de mejorar los modelos de cáncer en 3D para estudiar el crecimiento y la progresión del tumor en los pacientes y probar las respuestas a los nuevos tratamientos. En la actualidad, el 90% de los tratamientos exitosos contra el cáncer probados preclínicamente fracasan en las primeras fases de los ensayos clínicos y menos del 5% de los medicamentos oncológicos tienen éxito en los ensayos clínicos.
Las pruebas preclínicas se basan principalmente en una combinación de cultivos celulares de laboratorio bidimensionales (2-D) y modelos animales para predecir las respuestas al tratamiento. Sin embargo, los cultivos de células 2-D convencionales no logran imitar las características clave de los tejidos tumorales, y las diferencias entre especies pueden dar como resultado que muchos tratamientos exitosos en huéspedes animales sean ineficaces en humanos.
Son necesarios nuevos modelos experimentales de cáncer en 3D
En consecuencia, se necesitan nuevos modelos experimentales de cáncer en 3D para recrear mejor el microambiente del tumor humano e incorporar diferencias específicas de cada paciente.
El autoensamblaje es el proceso mediante el cual los sistemas biológicos ensamblan de manera controlada múltiples moléculas y células en tejidos funcionales. Aprovechando este proceso, el equipo creó un nuevo biomaterial de hidrogel elaborado con proteínas múltiples, aunque específicas, que se encuentran en el cáncer de páncreas. Este mecanismo de formación permite la incorporación de tipos de células clave para crear entornos biológicos que pueden emular las características del tumor de un paciente.
El profesor Mata agrega que «el uso de modelos de cáncer humano es cada vez más común en el desarrollo de tratamientos para la enfermedad, pero una barrera importante para lograr que se utilicen en aplicaciones clínicas es el tiempo de respuesta. Hemos diseñado un modelo ex vivo completo y sintonizable de adenocarcinoma ductal pancreático (PDAC) mediante el ensamblaje y la organización de componentes clave de la matriz con células derivadas del paciente. Los modelos exhiben perfiles transcripcionales específicos del paciente, funcionalidad CSC y una fuerte tumorigenicidad; en general, proporcionan un escenario más relevante que los cultivos organoides y de esfera. Lo más importante es que las respuestas a los fármacos fueron mejor reproducidas en nuestros cultivos autoensamblados que en los otros modelos«.
“Creemos que este modelo se acerca más a la visión de poder llevar las células tumorales del paciente al hospital, incorporarlas a nuestro modelo, encontrar el cóctel óptimo de tratamientos para un cáncer en particular y devolverlo al paciente, todo en un corto período de tiempo”, concluye Mata. “Aunque esta visión de la medicina de precisión para el tratamiento de esta enfermedad aún está lejos, esta investigación proporciona un paso hacia su realización«.
Fuente: Universidad de Nottingham.






















