Investigadores de la Facultad de Medicina de la Universidad de California en San Diego han descubierto una vía molecular fundamental para el inicio de los tumores pancreáticos. El mecanismo también podría contribuir a la alta resistencia de la enfermedad a la quimioterapia y la propensión a la metástasis del cáncer de páncreas.
El estudio, publicado el 16 de enero de 2023 en Nature Cell Biology, encontró que las células iniciadoras de tumores pancreáticos primero deben superar el «estrés de aislamiento» local mediante la creación de su propio microambiente promotor de tumores, y luego reclutar células circundantes en esta red. Al dirigirse a esta vía iniciadora de tumores, las nuevas terapias podrían limitar la progresión, la recaída y la propagación del cáncer de páncreas.
El cáncer de páncreas es uno de los más letales, notoriamente resistente al tratamiento. Casi todos los pacientes experimentan recurrencia o metástasis
En las primeras etapas de la formación del tumor, las células cancerosas (aquellas con mutaciones cancerosas, llamadas oncogenes) experimentan una pérdida de adhesión a otras células y a la matriz extracelular, la red de macromoléculas que encierra y sostiene a todas las células. Este aislamiento conduce a una falta local de oxígeno y nutrientes. La mayoría de las células no sobreviven a ese estrés de aislamiento, pero cierto grupo de células sí puede.
Las células iniciadoras de tumores (TIC) juegan un papel importante en la formación, recurrencia y diseminación metastásica de los tumores. Lo que las distingue de otras células cancerosas es su resistencia a estas primeras condiciones deficientes. Al igual que los cactus en un desierto, pueden adaptarse al entorno hostil y preparar el escenario para una mayor progresión del tumor.
¿Controlar el crecimiento y la propagación del cáncer?
«Nuestro objetivo era comprender qué propiedades especiales tienen estas células iniciadoras de tumores y si podemos controlar el crecimiento y la propagación del cáncer interrumpiéndolas«, indica el autor principal del estudio, el doctor en medicina David Cheresh, profesor distinguido y vicepresidente de la Departamento de Patología de la Facultad de Medicina de UC San Diego y miembro del Centro de Cáncer Moores de la misma universidad.
Para responder a estas preguntas, el primer autor, el también doctor en medicina Chengsheng Wu, becario postdoctoral en el laboratorio de Cheresh, sometió líneas de células pancreáticas a varias formas de estrés, incluidos niveles bajos de oxígeno y azúcar. Luego identificó qué células podían adaptarse a las duras condiciones y observó qué genes y moléculas se modificaron en estas células.
Las células iniciadoras de tumores tolerantes al estrés mostraron niveles reducidos de un microARN supresor de tumores, miR-139-5p. Esto, a su vez, condujo a la regulación positiva del receptor de ácido lisofosfatídico 4 (LPAR4), un receptor acoplado a proteína G en la superficie celular.
Las células cancerosas solitarias construyen su propio microambiente de apoyo
«LPAR4 normalmente no se encuentra en células sanas, pero se activa en ambientes estresantes para ayudar a las células a sobrevivir, lo que es particularmente ventajoso para las células que inician tumores«, comenta Cheresh. Los investigadores encontraron que la expresión de LPAR4 promovía la producción de nuevas proteínas de la matriz extracelular, lo que permitía que las células cancerosas solitarias comenzaran a construir su propio microambiente de apoyo al tumor.
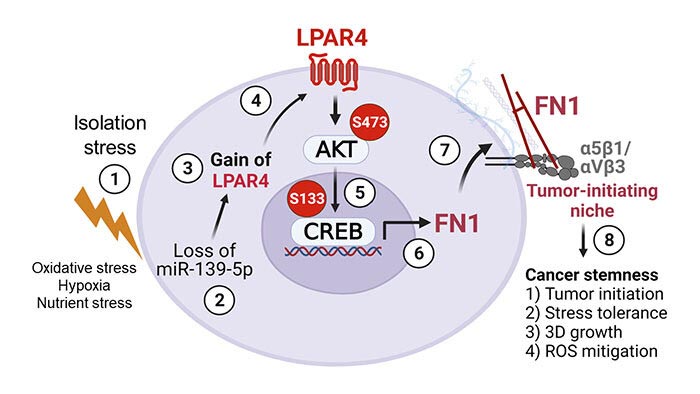
La nueva matriz extracelular era particularmente rica en fibronectina, una proteína que se une a los receptores transmembrana llamados integrinas en las células circundantes. Una vez que las integrinas de estas células detectaron la fibronectina, comenzaron a enviar señales a las células para que expresaran sus propios genes iniciadores de tumores. Eventualmente, estas otras células fueron reclutadas en la matriz de fibronectina depositada por las células iniciadoras del tumor y comenzó a formarse un tumor.
Probable conexión con otros cánceres epiteliales
«Nuestros hallazgos establecen un papel crítico para LPAR4 en la iniciación del tumor pancreático y un papel probable en otros cánceres epiteliales, como el cáncer de pulmón«, asegura Cheresh. «Es fundamental para la capacidad de las células iniciadoras de tumores para superar el estrés del aislamiento y construir su propio nicho en el que se pueden formar los tumores«.
Pero el estrés del aislamiento no es la única forma en que se puede activar esta vía de señalización, según los investigadores. Los medicamentos de quimioterapia también están diseñados para someter a estrés a las células cancerosas. De hecho, el equipo de Cheresh descubrió que el tratamiento de células tumorales cultivadas y tumores pancreáticos en ratones con quimioterapia estándar también condujo a la regulación positiva de LPAR4. Los investigadores comentan que esto podría explicar cómo esas células tumorales podrían desarrollar tolerancia al estrés y resistencia a los medicamentos.
Antagonistas de la integrina
Otros experimentos también demostraron que el uso de antagonistas de la integrina para bloquear la capacidad de las células para utilizar la matriz de fibronectina revirtió el beneficio de tolerancia al estrés de la expresión de LPAR4. Por lo tanto, los autores sugieren que dirigirse a la vía LPAR4 o interrumpir la interacción fibronectina/integrina podría ser eficaz para prevenir el crecimiento, la propagación y la resistencia a los fármacos de los tumores pancreáticos.
«Podemos pensar que las células iniciadoras de tumores se encuentran en un estado transitorio que puede ser inducido por diferentes factores estresantes, por lo que nuestro objetivo clínico sería evitar que las células oncogénicas entren en este estado«, indica Cher. «Ahora que hemos identificado el camino, podemos evaluar todas las diferentes formas en que podemos intervenir«.
Los investigadores sugirieron que un nuevo fármaco dirigido a esta vía podría usarse como profiláctico en pacientes con alto riesgo de desarrollar la enfermedad, o para prevenir la formación de nuevos tumores en casos de cáncer con una alta probabilidad de metástasis, como el cáncer de páncreas.
Varios frentes de lucha abiertos simultáneamente
Combinar el nuevo fármaco con los quimioterapéuticos existentes que ejercen presión sobre las células tumorales maduras también podría mitigar los efectos de la resistencia a los fármacos y hacer que los tratamientos contra el cáncer sean más efectivos, según los autores.
«El tratamiento del cáncer puede asemejarse un poco a golpear un topo«, concluye Cheresh, «pero si tenemos dos o tres martillos y sabemos dónde aparecerán a continuación, podemos ganar el juego«.
Fuente: Nature Cell Biology.






















