Una proteína camaleónica en las neuronas puede cambiar de opinión y, en el proceso, transformar nuestro cerebro. Científicos de la Universidad Rice y el Centro de Ciencias de la Salud de la Universidad de Texas en Houston (UTHealth) descubrieron nuevas pistas en la proteína CPEB3 como parte de la comprensión del mecanismo que permite a los humanos conservar la memoria a largo plazo.
El estudio del biofísico teórico de Rice Peter Wolynes y de Neal Waxham, neurobiólogo de la Facultad de Medicina McGovern de UTHealth, proporciona información sobre un ciclo de retroalimentación positiva entre la formación de la columna vertebral de actina que le da a las espinas dendríticas su forma y flexibilidad y los dominios de unión a actina en CPEB3, un prión funcional que se une al ARN, que también forma agregados de larga duración que pueden almacenar la materia de la que están hechos los recuerdos.
Los modelos de plegamiento de proteínas de Wolynes y su grupo en el Centro de Rice que estudia Física Biológica Teórica (CTBP) y los experimentos en UTHealth revelaron detalles estructurales previamente desconocidos para CPEB3 y cómo se une a la actina, tal y como informan los investigadores en el artículo Proceedings of the National Academy of Sciences.
En el proceso, también examinaron el papel clave que desempeña una proteína conocida como SUMO, un regulador que se adhiere y se desprende de otras proteínas en las células para modificar sus funciones. Los investigadores sospechan que ayuda a regular cuándo y cómo los extremos camaleónicos de CPEB3 (el extremo N y el extremo C) se unen a SUMO o las espinas flexibles y filamentosas de actina (f-actina) en picos dendríticos.
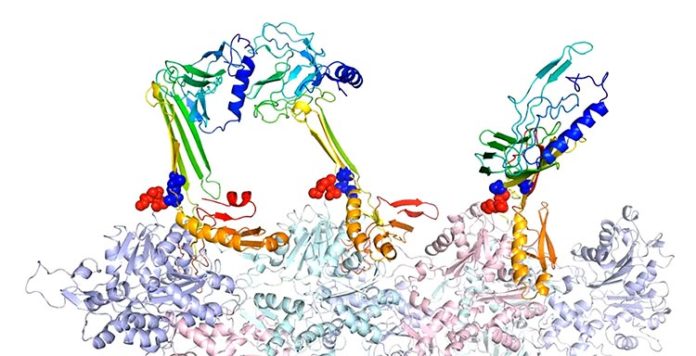
Los investigadores de la Universidad de Rice modelaron las estructuras de unión de la actina y las proteínas asociadas que creen que son responsables de la formación de la memoria a largo plazo.
Las proteínas CPEB3 son solubles cuando se unen a SUMO, que también entierra sus lugares de unión a la actina. Pero durante la actividad sináptica, pueden deshacerse de SUMO y estar disponibles para unirse con las bolsas de unión hidrófobas a lo largo de los filamentos de f-actina.
Aún falta trabajo para tener una visión completa de cómo se forma la memoria a largo plazo
Los modelos muestran que cuando se siente atraída por la actina, CPEB3 pasa de una espiral enrollada de hélices a una estructura de hoja beta que se «cierra» en una configuración de horquilla que le permite agregarse con otras proteínas CPEB3.
Tras la agregación, CPEB3 parece traducir sus ARN mensajeros objetivo, que incluyen ARNm de actina que fortalece las uniones sinápticas esenciales para la memoria, completando el ciclo positivo.
«Este es un proyecto más ambicioso que el simple estudio de actina-CaM quinasa, donde también simulamos un sistema de actina realmente enorme con una proteína realmente enorme«, afirma Wolynes. En ese estudio, publicado hace un año, los investigadores de CTBP modelaron cómo una proteína central (CaMKII) mantiene unidos los filamentos de actina paralelos, un estado que el laboratorio de Waxham podría visualizar en un microscopio electrónico.
Ahora los investigadores están definiendo los detalles estructurales que permiten que CPEB3 se una a la actina o al SUMO, pero no a ambos. «Uno de los aspectos principales de este artículo es reconciliar esas dos partes bastante diferentes de la historia«, comenta. «Creemos que los terminales CPEB son camaleónicos porque permiten que la molécula elija si interactuará con SUMO o con la actina«.
«Aún no hemos llegado al final de la historia«, afirma Wolynes. «Pero los últimos resultados nos colocan en un lugar razonable para profundizar más en el mecanismo«.
Fuente: Rice University.