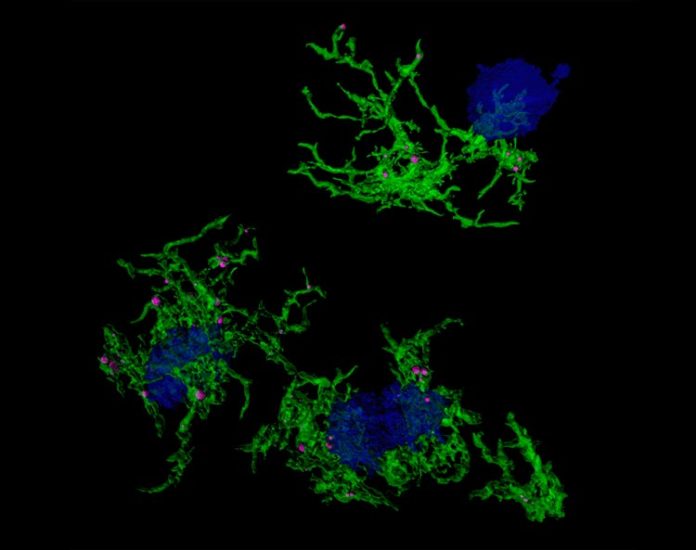
La enfermedad de Alzheimer es la forma más común de demencia y se caracteriza por la acumulación de placas amiloides en el cerebro. La microglía, los centinelas inmunes del cerebro, no sólo son responsables de eliminar los invasores extraños, sino también de mantener la homeostasis del cerebro al eliminar los desechos tóxicos como las placas amiloides.
Sin embargo, el papel de la microglía en la enfermedad de Alzheimer y su relación con la acumulación de placa amiloide sigue sin estar claro. Ahora, un equipo de científicos de la Facultad de Medicina de Duke-NUS y la Universidad de Monash ha encontrado las firmas de expresión génica subyacentes a la microglía asociada con la fagocitosis de la placa amiloide, es decir, la absorción de depósitos de proteína beta amiloide (Aβ) en el cerebro. Los hallazgos, publicados en la revista Nature Communications, ofrecen un nuevo objetivo para las intervenciones que tienen como objetivo abordar el mecanismo subyacente de esta enfermedad incurable.
Para investigar las diferencias entre los cerebros sanos y los de los pacientes con enfermedad de Alzheimer en la resolución unicelular, el equipo de científicos de Duke-NUS y Monash se embarcó en un proyecto integral para estudiar los cambios en la expresión génica en tipos específicos de células del cerebro humano que están asociados con la progresión de la enfermedad de Alzheimer. A partir de ese estudio, que se publicó en Nature Neuroscience en 2019, el equipo se centró en la microglía.
Para las microglías que no han absorbido amiloide, los patrones de expresión genética son más similares a los de la microglía envejecida
«Intentamos comprender los mecanismos moleculares y las diferencias entre las microglías que envolvían activamente las placas amiloides en la enfermedad de Alzheimer y las que no lo estaban«, comenta el profesor asociado Enrico Petretto, del Programa de Trastornos Cardiovasculares y Metabólicos de Duke-NUS, coautor principal del estudio.
El equipo hizo esto mediante el uso de una tinción llamada metoxi-XO4 que se dirige específicamente a la microglía que ha engullido placas de amiloide. Utilizaron la tinción en modelos preclínicos de la enfermedad de Alzheimer y luego examinaron la expresión génica en la microglía teñida. Investigaron las diferencias en la expresión génica subyacentes a la capacidad de la microglía para ingerir partículas (por ejemplo, placa amiloide) e identificaron moléculas reguladoras asociadas.
«Comprender este mecanismo es importante porque ahora tenemos varios objetivos nuevos que perseguir, y en el futuro, estos objetivos pueden abrir un nuevo frente contra esta devastadora enfermedad«, afirma el profesor José M. Polo del Monash Biomedicine Discovery Institute, coautor principal del estudio.
Los estudios revelaron que para las microglías que no han absorbido amiloide, los patrones de expresión genética son más similares a los de la microglía envejecida, que se sabe que son disfuncionales y actores importantes en la patogénesis de la enfermedad de Alzheimer. Además, después de que la microglía engulle las placas amiloides asociadas con la enfermedad de Alzheimer, desarrollan un patrón o firma de expresión genética característico. Este cambio en la expresión génica es inducido, en parte, por un gen llamado Hif1a. La expresión genética modificada aumenta la capacidad de la microglía para absorber proteínas como la amiloide, mientras que la reducción de Hif1a hace lo contrario, lo que destaca la importancia de Hif1a en el control de esta función de la microglía. Este papel regulador de Hif1a también podría aplicarse a la función de la microglía de eliminar las sinapsis dañadas.
El equipo también utilizó modelos computacionales para identificar objetivos potenciales para estudiar en el desarrollo de fármacos
«Es posible que este proceso sea inicialmente protector«, especula el profesor adjunto Petretto, «con la microglía podando efectivamente las sinapsis dañadas ubicadas cerca de las placas«. Los científicos sospechan, sin embargo, que este proceso de poda más tarde fracasa a medida que avanza la enfermedad.
El equipo también utilizó modelos computacionales para predecir las redes de moléculas involucradas en la absorción de proteínas por microglía e identificó objetivos potenciales para estudiar para el desarrollo de fármacos. Se descubrió que el fármaco inmunosupresor ampliamente utilizado rapamicina, por ejemplo, bloquea el gen Hif1a para que no provoque que la microglía engulla las placas amiloides.
«Esta relación entre Hif1a y el deterioro cognitivo en la enfermedad de Alzheimer aún no se ha descubierto de forma exhaustiva«, asegura el estudiante de doctorado Gabriel Chew, coprimer autor del artículo. «El trabajo futuro podría centrarse en el uso de la herramienta de edición de genes CRISPR para probar el impacto de la manipulación de Hif1a en la gravedad de los síntomas y la progresión de la enfermedad«.
Fuente: Nature Communications.


























