Algunos de los desafíos más difíciles en el tratamiento de enfermedades los presentan las proteínas «no susceptibles de tratamiento» cuyas estructuras y funciones en la enfermedad se conocen, pero aparentemente no pueden ser atacadas por fármacos que se unan a ellas. Los investigadores de KAUST ahora han demostrado que el movimiento molecular de muchas proteínas «no susceptibles de tratamiento» puede, de hecho, exponer sitios en los que los fármacos podrían unirse para tratar enfermedades, entre ellas algunos cánceres incurables.
Su estudio se publica en Nature Communications.
La investigación se centra en una región molecular particular, llamada dominio BTB, que se sabe que es una parte crítica de más de 350 proteínas. Permite que las proteínas se unan a otras proteínas para influir en complejos procesos genéticos y de señalización molecular que son fundamentales para las actividades de muchas células.
«Esto significa que ahora se pueden reconsiderar algunas proteínas diana aparentemente no susceptibles de tratamiento, con la firme esperanza de identificar nuevos compuestos principales para el desarrollo de fármacos contra ciertos cánceres«
Más de 80 proteínas que contienen BTB conocidas son factores de transcripción que controlan las actividades de los genes, una función que significa que muchas de ellas están implicadas en el cáncer. Como el dominio BTB ha resultado difícil de atacar con medicamentos, estos cánceres a menudo son fatales.
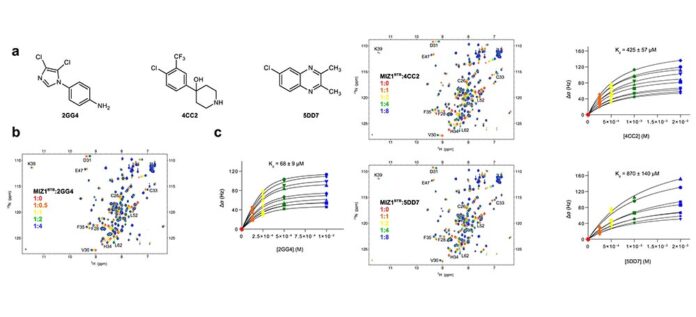
El equipo de KAUST, junto con colegas de la Universidad de Michigan en los EE.UU., realizó un análisis detallado de los movimientos moleculares de los dominios BTB en tres proteínas involucradas en el cáncer.
Regiones diámicas de dominios BTB que parecen disponibles para unirse a ligandos
Los resultados descubrieron el papel del movimiento molecular al influir en la capacidad de las moléculas pequeñas, conocidas colectivamente como ligandos, para unirse al dominio BTB. Esto reveló sitios de unión crípticos: regiones dinámicas de dominios BTB que parecen disponibles para unirse a ligandos, a diferencia de las estructuras estáticas.
«Esto significa que ahora se pueden reconsiderar algunas proteínas diana aparentemente no susceptibles de tratamiento, con la firme esperanza de identificar nuevos compuestos principales para el desarrollo de fármacos contra ciertos cánceres«, indica Łukasz Jaremko, del equipo de KAUST. «La heroína de nuestro estudio, llamada proteína MIZ1, está relacionada con c-MYC, el gen oncogén que causa cáncer en más del 70% de los cánceres, y ahora puede ser el objetivo de las campañas de descubrimiento de fármacos«.
El próximo desafío consiste en comprender del todo los mecanismos que convierten a estos sitios de unión en difíciles de detectar
Los investigadores se sorprendieron al descubrir cuán importante podría ser el movimiento de las proteínas para controlar los sitios de unión de los ligandos, aunque reconocieron que parece lógico en retrospectiva.
La primera autora Vladlena Kharchenko, exinvestigadora en KAUST, donde fue estudiante de doctorado y ahora becaria postdoctoral en el Colegio de Medicina Albert Einstein en los EE.UU., comenta que el próximo desafío es comprender completamente los mecanismos que permiten que los movimientos moleculares hagan que los sitios de unión crípticos sean tan difíciles de detectar e interactuar.
Un estudio que podría impactar en muchos tipos de cáncer
«También queremos encontrar estos sitios en otras proteínas, para avanzar en el proceso de descubrimiento de fármacos para muchas otras proteínas actualmente no susceptibles de tratamiento y, en última instancia, dar una nueva esperanza para el tratamiento de enfermedades actualmente incurables, incluidas muchas formas de cáncer«, concluye Kharchenko.
Fuente: Nature Communications.






















