Un equipo de investigación de Virginia Tech, en colaboración con University of Missouri-Columbia ha descubierto un mecanismo responsable de la resistencia a los antibióticos de las bacterias que causan la tuberculosis y la lepra. Este conocimiento permitirá a los investigadores diseñar medicamentos más efectivos para tratar ambas enfermedades. Estos hallazgos han sido publicados recientemente en la revista Biochemistry.
La Rifampicina, un popular antibiótico utilizado para tratar la tuberculosis y la lepra, funciona impidiendo el crecimiento de estas bacterias. Sin embargo, este medicamento cada vez es menos efectivo a medida que Mycobacterium tuberculosis, la bacteria que causa la tuberculosis, y Mycobacterium leprae, que causa la lepra, desarrollan resistencia.
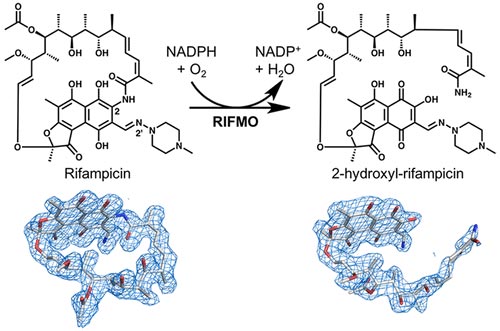
Esta resistencia se produce en parte porque las bacterias tienen una enzima, rifampicina monooxigenasa, que inactiva la rifampicina modificando químicamente su estructura.
Pablo Sobrado, profesor de bioquímica en el College of Agriculture and Life Sciences y su equipo, en colaboración con el también bioquímico John Tanner, trabajaron con el estudiante postdoctoral Li-Kai Liu, de University of Missouri-Columbia, para descubrir que la rifampicina monooxigenasa convierte la rifampicina de agente cíclico con forma de anillo a un agente lineal. Una vez que se encuentra en esta forma lineal, deja de ser efectiva para acabar con la bacteria.
«Este descubrimiento es emocionante porque es de suma importancia para el diseño de fármacos”, asegura Sobrado. «Puede ayudar a los investigadores a diseñar análogos de la rifampicina más efectivos porque no sean susceptible de ser inactivados por la enzima de las bacterias”.
Otros miembros del equipo de Sobrado ayudaron a identificar el mecanismo, como Yumin Dai, investigador asociado senior del Departamento de Química en College of Science, y el estudiante graduado Heba Abdelwahab, de Damietta, Egipto. En un estudio previo, Abdelwahab descubrió la estructura atómica y molecular de la rifampicina monooxigenasa, gracias a la cristalografía de rayos X.
En este estudio reciente, financiado por National Science Foundation de los EEUU, el equipo de Sobrado utilizó cristalografía de rayos X, análisis de NMR y espectroscopía de masas para identificar la modificación de rifampicina por la rifampicina monooxigenasa. Antes de este hallazgo, los investigadores ya sabían que la rifampicina monooxigenasa inactivaba la rifampicina, pero no comprendían cómo sucedía.
«La resistencia a los antibióticos es un problema en evolución que tiene un gran impacto en la salud pública”, confirma Abdelwahab. «Nuestros estudios han mostrado cómo esta enzima desactiva la rifampicina. Ahora tenemos un plan para inhibir esta enzima”.
Dai asegura que «Basándonos en el conocimiento de este mecanismo, el siguiente paso consiste en desarrollar varios inhibidores de esa enzima para tratar la resistencia al antibiótico, como simplificaciones estructurales de la rifampicina, que podrían actuar como inhibidores competitivos”.
Los investigadores también pueden comenzar a diseñar formas mejoradas sintéticas de la rifampicina que no sean susceptibles de modificación química por la enzima de las bacterias que causan ambas enfermedades.
Más de diez millones de personas en el mundo enfermaron de tuberculosis en todo el mundo en 2016. Las cifras de prevalencia de la lepra son bastante menores, ya que unos 10.000 casos son detectados cada año, el 96% en países en vías de desarrollo.
Fuente: Biochemistry.