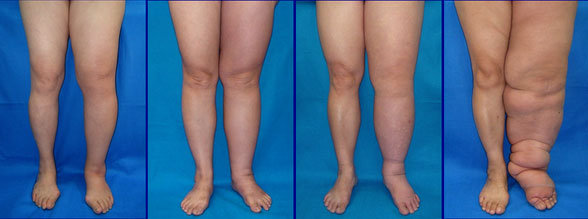
El sistema linfático humano consta de una amplia red de vasos que drenan el líquido rico en proteínas de los tejidos y lo transportan a los ganglios linfáticos. Cuando la maquinaria falla y los vasos linfáticos no drenan adecuadamente, el líquido se acumula en los tejidos, provocando una hinchazón dolorosa conocida como linfedema. Una colaboración dirigida por la Universidad de Cornell construyó un modelo 3D in vitro de un vaso linfático humano funcional que reveló un mecanismo sorprendente que puede bloquear el drenaje necesario: una proteína expresada en las células endoteliales linfáticas llamada proteína quinasa 2 asociada a rho (ROCK2).
Los investigadores demostraron que al inhibir ROCK2 pueden revertir los efectos del linfedema, creando un tratamiento potencial para una afección que se estima que afecta a hasta 150 millones de personas en todo el mundo.
Cuando los investigadores inhibieron ROCK2, las uniones linfáticas se aflojaron y las uniones de los vasos sanguíneos se tensaron bajo la inflamación del linfedema, de modo que se pudo reanudar el drenaje normal de líquido
El artículo del equipo, «Un modelo biomimético 3D de linfáticos revela endurecimiento de la unión entre células y linfedema a través de un complejo ROCK2/JAM-A inducido por citocinas«, fue publicado en Proceedings of the National Academy of Sciences. El autor principal del artículo es Esak (Isaac) Lee, investigador de ciencias biológicas de la familia Meinig y profesor asistente de ingeniería biomédica en Cornell Engineering.
«El linfedema tiene muchísimos pacientes en el mundo«, asegura Lee. «Los médicos generalmente sugieren usar una prenda de compresión o hacer alguna fisioterapia, como masajes, para bombear todos estos fluidos de los brazos y las piernas. Desafortunadamente, no existe ningún medicamento aprobado por la FDA porque no entendemos el mecanismo de esta enfermedad”.
«Linfáticos en un chip»
Los intentos de localizar ese mecanismo en los seres humanos se han visto frustrados por el hecho de que el sistema linfático está entrelazado con el sistema nervioso central, los movimientos musculares y otros procesos corporales.
Trabajando con investigadores de la Universidad de Boston (BU) y la Facultad de Medicina de Harvard, dirigidos por el coautor principal Christopher Chen de BU, Lee se propuso crear un modelo in vitro, o «linfáticos en un chip», que podría aíslar varios factores biológicos y biofísicos, como las citoquinas inflamatorias, la señal ROCK2 y la presión del líquido intersticial, mientras imita el drenaje.
El dispositivo transparente, del tamaño de un pulgar, reprodujo de manera realista la unión linfática «en forma de botón», el límite entre las células endoteliales que recubren los vasos linfáticos, con dos canales huecos en colágeno 3D. En el primer canal, el equipo sembró estas células humanas, que luego fueron presurizadas por el líquido intersticial cargado en el segundo canal. La alta presión del líquido abrió las uniones de los vasos linfáticos diseñados y la absorción de líquido las cerró. Luego, los investigadores pudieron medir la cantidad de líquido drenado a través del sistema.
Un modelo que imita de forma realista la biología humana
«Demostrar esta unión en forma de botón es crucial para recapitular la función linfática, que no había tenido éxito in vitro antes de nuestro estudio«, insiste Lee. «El desafío más importante fue crear las condiciones adecuadas: el tamaño de los vasos, la distancia entre dos canales, los factores de crecimiento utilizados y el tamaño de la presión del líquido intersticial. Todas estas cosas realmente afectan las uniones de los botones, por lo que queríamos hacer un modelo que imitara de manera realista la biología humana«.
Los investigadores introdujeron citocinas inflamatorias que se sabe que se expresan en pacientes con linfedema, como la interleucina-2 y el factor estimulante de colonias de granulocitos y macrófagos (GM-CSF), que tensan las uniones linfáticas, lo que provoca acumulación de líquido y linfedema.
Se reanudó el drenaje normal
Si bien se sabía anteriormente que estas citoquinas alteraban las uniones de los vasos sanguíneos, el modelo reveló que en realidad estaban estrechando las uniones entre las células endoteliales linfáticas e impidiendo el drenaje.
Cuando los investigadores inhibieron ROCK2, las uniones linfáticas se aflojaron y las uniones de los vasos sanguíneos se tensaron bajo la inflamación, de modo que se pudo reanudar el drenaje normal de líquido.
Demasiados inhibidores pan-ROCK distintos
«Existen entre 170 y 180 inhibidores pan-ROCK diferentes, pero generalmente conllevan efectos secundarios graves, como la hipotensión, cuando estos inhibidores de ROCK bloquean tanto ROCK1 como ROCK2, dos isoformas de ROCK«, indica Lee. «Sin embargo, los efectos secundarios de inhibir ROCK2 son mínimos, porque ROCK2 se expresa más en las células linfáticas que en las células del músculo vascular en los vasos sanguíneos, donde ROCK1 se expresa altamente. Esto lo convierte en un fuerte candidato para terapias que se dirigen a las enfermedades linfáticas con menos vascularización y toxicidad”.
Los colaboradores de Lee reprodujeron el experimento en ratones que perdieron ROCK2 en sus células linfáticas, lo que mostró una reducción dramática del edema en la cola de los animales.
Fuente: Proceedings of the National Academy of Sciences (PNAS).