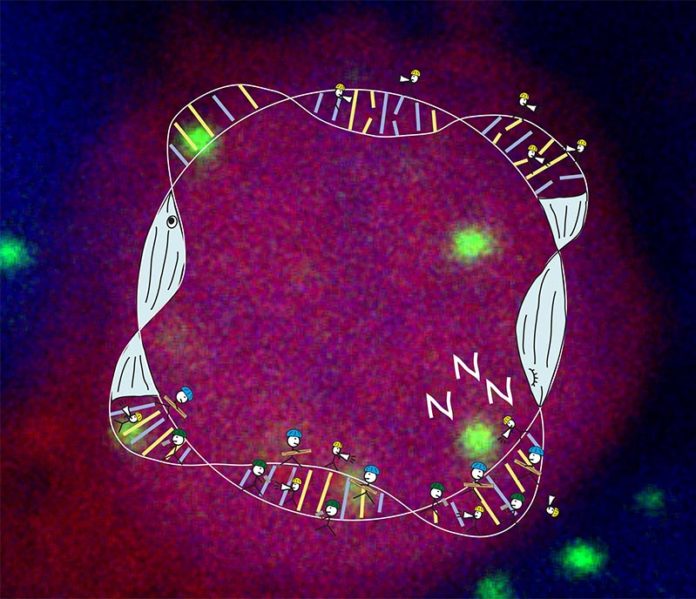
¿Por qué los humanos pasan un tercio de sus vidas durmiendo? ¿Por qué duermen en general los animales? A lo largo de la evolución, el sueño ha sido universal y esencial para todos los organismos con sistema nervioso, incluidos los invertebrados como moscas, gusanos e incluso medusas. Por qué los animales duermen a pesar de la continua amenaza de los depredadores y cómo dormir beneficia al cerebro y a las células individuales sigue siendo un misterio.
En un nuevo estudio publicado en la revista Molecular Cell, investigadores de la Universidad Bar-Ilan de Israel han dado un paso adelante para resolver este misterio, al descubrir un mecanismo del sueño en el pez cebra, con algunas pruebas de apoyo en ratones.
El estudio fue dirigido por el profesor Lior Appelbaum, de la Facultad de Ciencias de la Vida Goodman de Bar-Ilan y del Centro de Investigación Cerebral Multidisciplinario Gonda (Goldschmied), junto con el investigador postdoctoral David Zada.
Un sistema de reparación del ADN de la llamada al sueño promueve una reparación eficiente para que el día pueda comenzar de nuevo
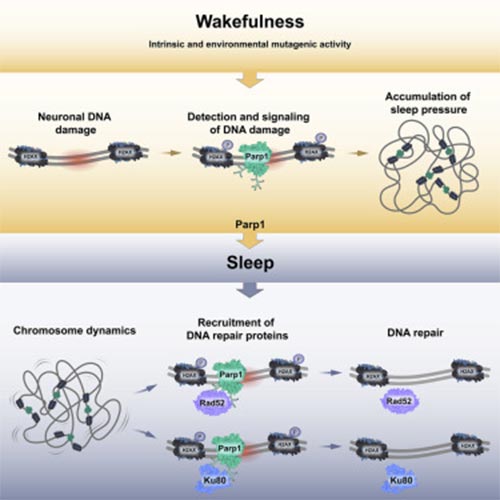
Cuando estamos despiertos, la presión homeostática del sueño (cansancio) se acumula en el cuerpo. Esta presión aumenta cuanto más tiempo permanecemos despiertos y disminuye durante mientras se duerme, alcanzando un nivel mínimo después de una noche de sueño completo y reparador.
¿Qué hace que la presión homeostática aumente hasta el punto en que sentimos que debemos irnos a dormir, y qué sucede por la noche, que reduce esta presión a tal punto que luego estamos listos para comenzar un nuevo día? Durante las horas de vigilia, el daño al ADN se acumula en las neuronas. Este daño puede ser causado por varios elementos, incluida la luz ultravioleta, la actividad neuronal, la radiación, el estrés oxidativo y los errores enzimáticos.
Durante las horas de sueño y vigilia, los sistemas de reparación dentro de cada célula corrigen las rupturas del ADN. Sin embargo, el daño del ADN en las neuronas continúa acumulándose durante la vigilia, y el daño excesivo del ADN en el cerebro puede alcanzar niveles peligrosos que deben reducirse. El estudio reveló que un sistema de reparación del ADN de la llamada al sueño promueve una reparación eficiente para que el día pueda comenzar de nuevo.
En una serie de experimentos, los investigadores buscaron determinar si la acumulación de daño en el ADN podría ser el «impulsor» que desencadena la presión homeostática y el estado de sueño subsiguiente. Usando irradiación, farmacología y optogenética, indujeron daño al ADN en el pez cebra para examinar cómo afectaba a su sueño. Con su absoluta transparencia, sueño nocturno y un cerebro simple y con semejanzas con el de los humanos, el pez cebra es un organismo perfecto para estudiar este fenómeno.
¿Cuántas horas de sueño son suficientes?
A medida que aumentaba el daño del ADN, también aumentaba la necesidad de dormir. El experimento sugirió que en algún momento la acumulación de daño en el ADN alcanzó un umbral máximo y aumentó la presión del sueño (homeostática) hasta tal punto que se desencadenó la necesidad de dormir y el pez se durmió. El sueño resultante facilitó la reparación del ADN, lo que resultó en una reducción del daño del ADN.
No hay nada como una buena noche de sueño. Después de verificar que el daño acumulado en el ADN es la fuerza que impulsa el proceso del sueño, los investigadores estaban ansiosos por saber si es posible determinar el tiempo mínimo que el pez cebra necesita para dormir para reducir la presión del sueño y el daño al ADN. Dado que, al igual que los humanos, el pez cebra es sensible a la interrupción de la luz, el período de oscuridad se redujo gradualmente durante la noche. Después de medir el daño del ADN y el sueño, se determinó que seis horas de sueño por noche son suficientes para reducir el daño del ADN en el pez cebra. Sorprendentemente, después de menos de seis horas de sueño, el daño al ADN no se redujo adecuadamente y el pez cebra continuó durmiendo incluso durante el día.
PARP1 es una «antena» que puede indicar que es hora de dormir
¿Cuál es el mecanismo en el cerebro que nos dice que necesitamos dormir para facilitar la reparación eficiente del ADN? La proteína PARP1, que forma parte del sistema de reparación de daños en el ADN, es una de las primeras en responder rápidamente. PARP1 marca los sitios de daño del ADN en las células y recluta todos los sistemas relevantes para eliminar el daño del ADN. De acuerdo con el daño del ADN, la agrupación de PARP1 en los sitios de rotura del ADN aumenta durante la vigilia y disminuye durante el sueño.
A través de la manipulación genética y farmacológica, la sobreexpresión y la caída de PARP1 revelaron no sólo que el aumento de PARP1 promueve el sueño, sino que también aumenta la reparación dependiente del sueño. Por el contrario, la inhibición de PARP1 bloqueó la señal de reparación del daño del ADN. Como resultado, los peces no estaban completamente conscientes de que estaban cansados, no se durmieron y no se produjo ninguna reparación del daño en el ADN.
Para fortalecer los hallazgos sobre el pez cebra, el papel de PARP1 en la regulación del sueño se probó en ratones utilizando EEG, en colaboración con el profesor Yuval Nir de la Universidad de Tel Aviv. Al igual que con el pez cebra, la inhibición de la actividad de PARP1 redujo la duración y la calidad del sueño con movimientos oculares no rápidos (NREM). «Las vías de PARP1 son capaces de indicar al cerebro que necesita dormir para que se produzca la reparación del ADN«, asegura el profesor Appelbaum.
Resolviendo el rompecabezas
En un estudio anterior, el profesor Appelbaum y su equipo utilizaron imágenes de lapso de tiempo en 3D para determinar que el sueño aumenta la dinámica cromosómica. Al agregar la pieza actual al rompecabezas, PARP1 aumenta el sueño y la dinámica cromosómica, lo que facilita la reparación eficiente del daño al ADN acumulado durante las horas de vigilia. El proceso de mantenimiento del ADN puede no ser lo suficientemente eficiente durante las horas de vigilia en las neuronas y, por lo tanto, requiere un período de sueño alejado de estímulos al cerebro para que ocurra.
Estos últimos hallazgos proporcionan una descripción detallada de la «cadena de eventos» que explica el sueño a nivel unicelular. Este mecanismo puede aclarar el vínculo entre las alteraciones del sueño, el envejecimiento y los trastornos neurodegenerativos, como el Parkinson y el Alzheimer. El profesor Appelbaum cree que la investigación futura ayudará a aplicar esta función del sueño a otros animales que van desde invertebrados inferiores hasta, eventualmente, humanos.
Fuente: Molecular Cell.