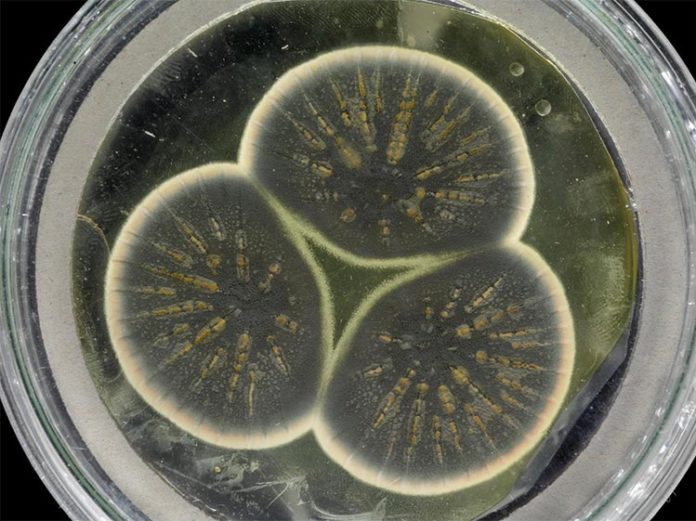
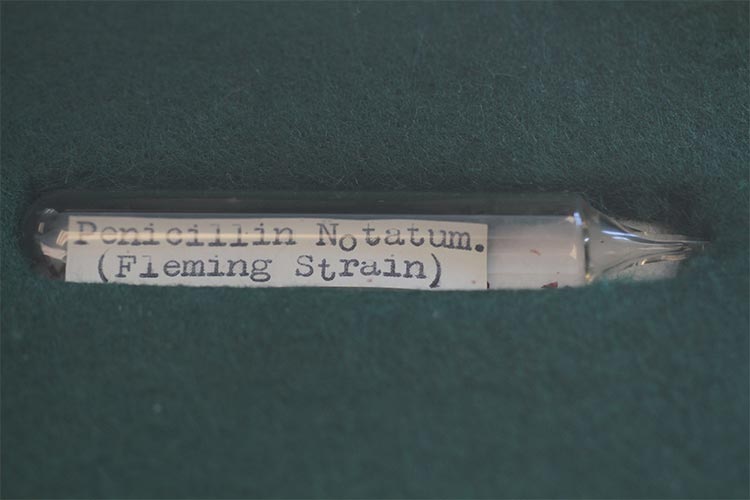
Los investigadores han secuenciado el genoma del molde de penicilina de Alexander Fleming por primera vez y lo han comparado con versiones posteriores. Fleming descubrió el primer antibiótico, la penicilina, en 1928 mientras trabajaba en St. Mary’s Hospital Medical School, que ahora forma parte del Imperial College London. El antibiótico fue producido por un moho del género Penicillium que accidentalmente comenzó a crecer en una placa de Petri.
Ahora, investigadores del Imperial College London, CABI y la Universidad de Oxford han secuenciado el genoma de la cepa Penicillium original de Fleming utilizando muestras que se congelaron vivas hace más de cincuenta años.
El equipo también utilizó el nuevo genoma para comparar el moho de Fleming con dos cepas de Penicillium de los EE.UU. que se utilizan para producir el antibiótico a escala industrial. Los resultados, publicados hoy en Scientific Reports, revelan que las cepas de Reino Unido y EE.UU. utilizan métodos ligeramente diferentes para producir penicilina, lo que sugiere potencialmente nuevas rutas para la producción industrial y podría ayudar a combatir la resistencia a los antibióticos.
El investigador principal, el profesor Timothy Barraclough, del Departamento de Ciencias de la Vida en Imperial y el Departamento de Zoología en Oxford, comenta que «originalmente nos propusimos usar el hongo de Alexander Fleming para algunos experimentos diferentes, pero nos dimos cuenta, para nuestra sorpresa, de que nadie había secuenciado el genoma de este Penicillium original, a pesar de su importancia histórica para este campo de la ciencia«.
Aunque el moho de Fleming es famoso como la fuente original de penicilina, la producción industrial rápidamente pasó a utilizar hongos de melón en los EE.UU. A partir de estos comienzos naturales, las muestras de Penicillium se seleccionaron artificialmente para cepas que producen mayores volúmenes de penicilina.
El equipo volvió a cultivar el Penicillium original de Fleming a partir de una muestra congelada guardada en la colección de cultivos en CABI y extrajo el ADN para su secuenciación. El genoma resultante se comparó con los genomas publicados anteriormente de dos cepas industriales de Penicillium utilizadas más tarde en los EE.UU.
Los investigadores observaron en particular dos tipos de genes: los que codifican las enzimas que usa el hongo para producir penicilina, y los que regulan las enzimas, por ejemplo controlando cuántas de ellas se producen. Tanto en las cepas del Reino Unido como de los Estados Unidos, los genes reguladores tenían el mismo código genético, pero las cepas estadounidenses tenían más copias de los genes reguladores, lo que ayudaba a esas cepas a producir más penicilina.
Sin embargo, los genes que codifican las enzimas productoras de penicilina difieren entre las cepas aisladas en el Reino Unido y Estados Unidos. Los investigadores dicen que esto muestra que el Penicillium salvaje en el Reino Unido y Estados Unidos evolucionó de forma natural para producir versiones ligeramente diferentes de estas enzimas.
Los mohos como el Penicillium producen antibióticos para combatir los microbios, y están inmersos en una carrera armamentista constante a medida que los microbios desarrollan formas de evadir estas defensas. Las cepas de Reino Unido y EE.UU. probablemente evolucionaron de manera diferente para adaptarse a sus microbios locales.
La evolución microbiana es un gran problema hoy en día, ya que muchos se están volviendo resistentes a nuestros antibióticos. Aunque los investigadores afirman no conocer las consecuencias de las diferentes secuencias de enzimas en las cepas del Reino Unido y Estados Unidos para el eventual antibiótico, dicen que sí plantea la intrigante perspectiva de nuevas formas de modificar la producción de penicilina.
El primer autor Ayush Pathak, del Departamento de Ciencias de la Vida de Imperial, asegura que «nuestra investigación podría ayudar a inspirar soluciones novedosas para combatir la resistencia a los antibióticos. La producción industrial de penicilina se concentró en la cantidad producida, y los pasos utilizados para mejorar artificialmente la producción llevaron a cambios en cierto número de genes”.
«Pero es posible que los métodos industriales hayan pasado por alto algunas soluciones para optimizar el diseño de la penicilina”, añade Pathak, “y podamos aprender de las respuestas naturales a la evolución de la resistencia a los antibióticos«.
Fuente: Nature.